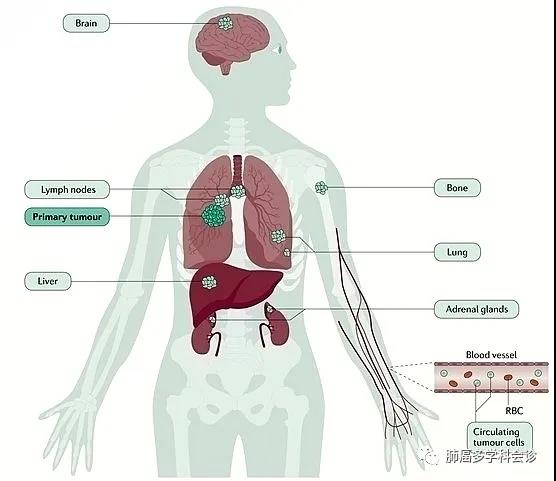
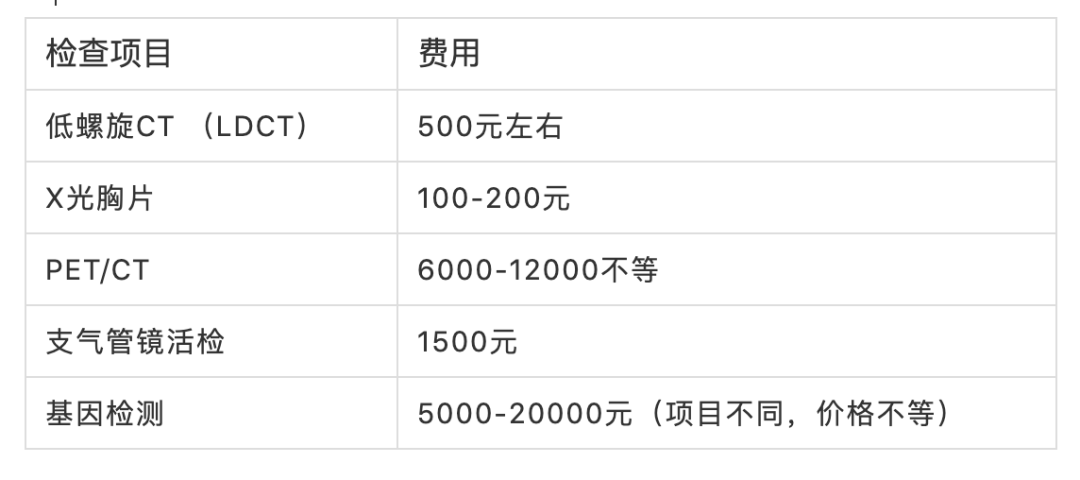
推荐等级和证据水平

组织和生物标志物
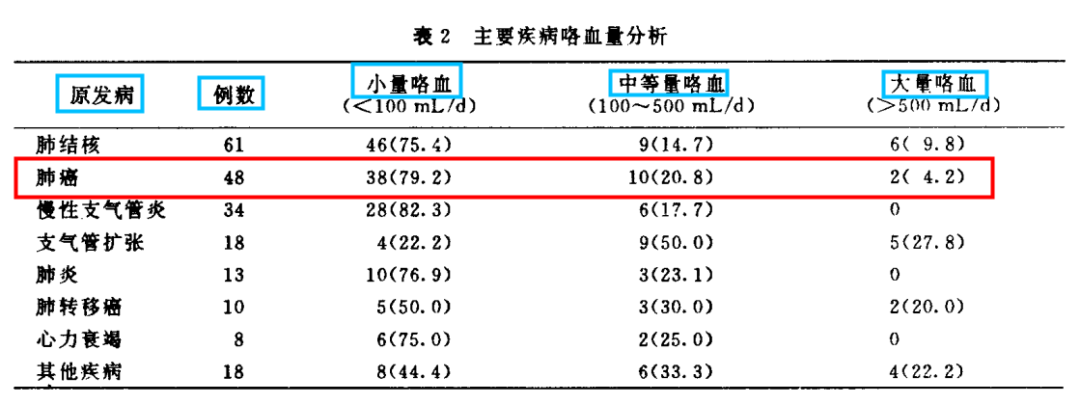
问题1:是否有必要检测所有具有临床实用性的(包括常见和非典型/罕见)EGFR突变?
共识:推荐检测EGFR基因18、19、20、21外显子上所有确定的或潜在的临床意义突变,最好是NGS(二代测序)方法。
证据水平:I,推荐等级:A。
讨论:所有非小细胞肺癌患者,不论疾病分期,均应由病理学家在最初诊断时进行全面的生物标志物检测,包括EGFR基因。
最常见的EGFR突变为19外显子缺失突变(45%所有EGFR突变)和21外显子L858R点突变(40%所有EGFR突变)。非典型/罕见EGFR突变,包括19外显子插入突变,18外显子点突变(3%所有EGFR突变),21外显子L861Q点突变(2%所有EGFR突变)和20外显子S768I点突变(2%所有EGFR突变)。这些常见和非典型/罕见EGFR突变对EGFR酪氨酸激酶抑制剂具有程度不一的敏感性。
另一方面,大多数 20外显子插入突变(4-10%所有EGFR突变)和某些EGFR突变,如L747S,D761Y,T790M和T854A等与EGFR酪氨酸激酶抑制剂耐药有关。
部分患者的肿瘤组织中存在两种及以上不同类型的EGFR突变,即EGFR复合突变,可能会影响EGFR酪氨酸激酶抑制剂的疗效。
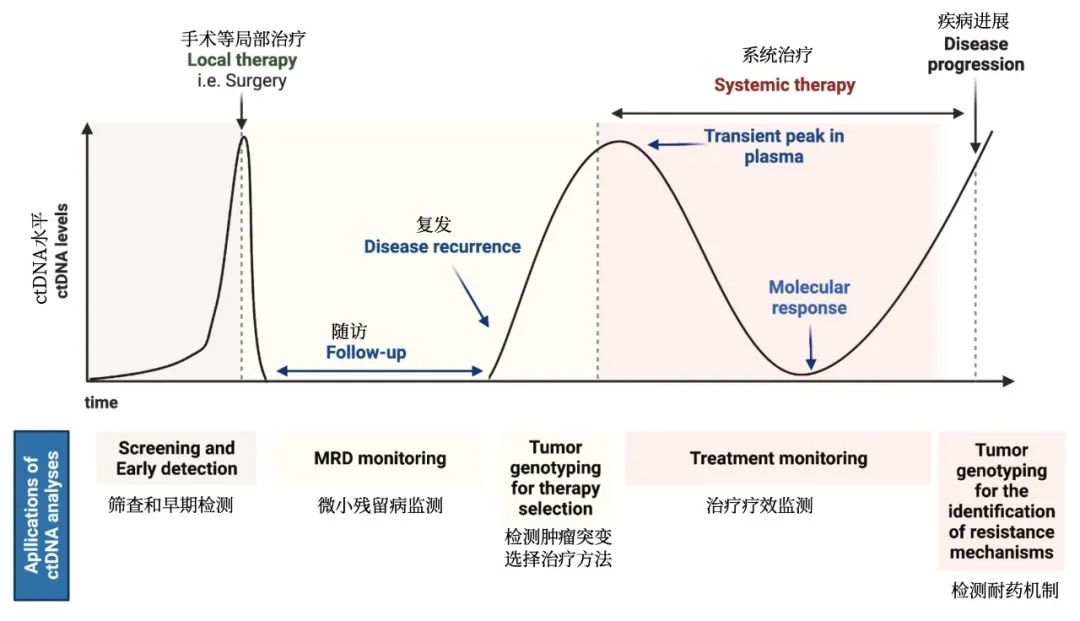
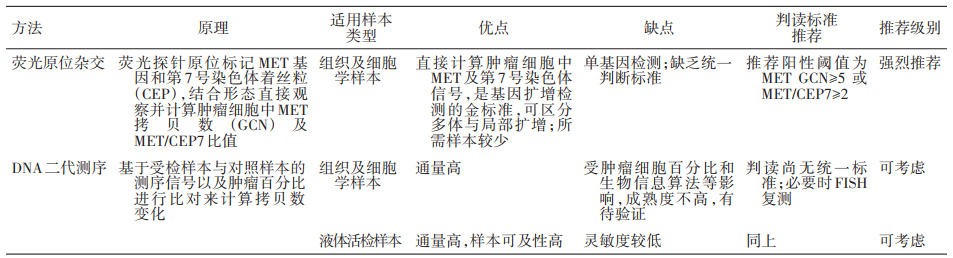
相对单EGFR基因检测,二代测序更全面快速,在缺乏组织样本时,进行血液样本的外周血游离DNA检测。
31位专家投票,30位赞同,1位弃权。
问题2:EGFR突变非小细胞肺癌患者疾病进展时进行组织再活检的地位?
共识:可行时,推荐EGFR突变非小细胞肺癌患者疾病进展时进行组织再活检,以确定分子和组织学转变。
证据水平:I,推荐等级:A。
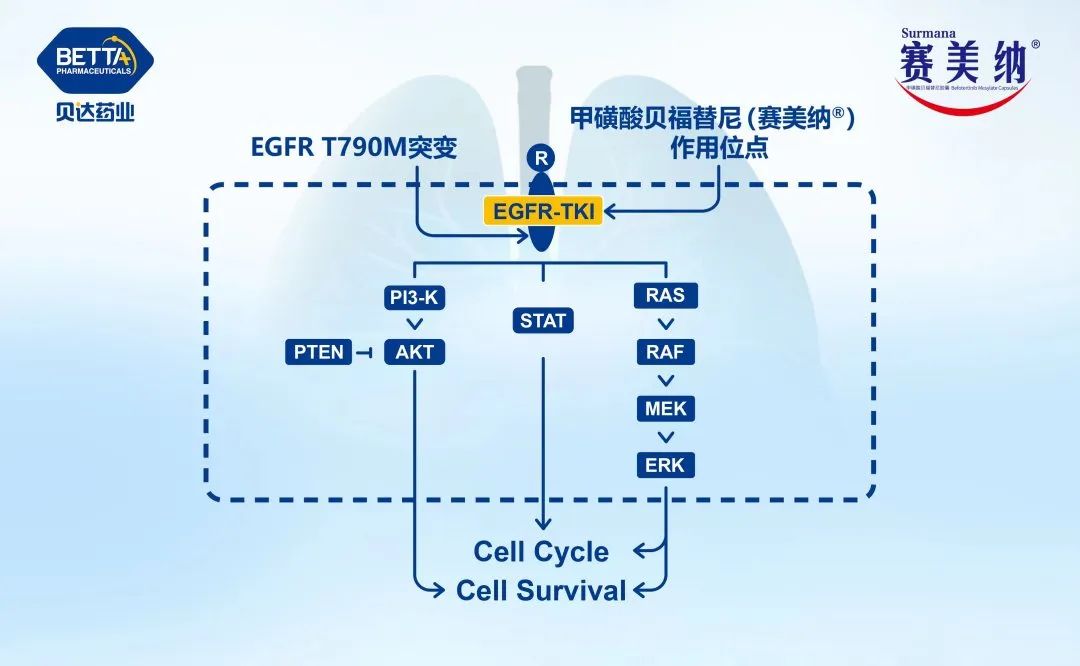
讨论:几乎所有的EGFR突变非小细胞肺癌患者接受EGFR靶向治疗时会发生耐药,可分为三种耐药机制:(1)靶标(EGFR)相关的耐药(on-targetresistance),如T790M和C797S突变等;(2)非靶标相关耐药机制(Off-target resistance),如MET扩增和BRAF突变等 ;(3)组织学转变,如小细胞肺癌转化等。
推荐基于DNA或RNA的二代测序(NGS)。二代测序对基因融合的检测有优势,但对MET扩增的检出率低于FISH。
在缺乏组织样本时,液体样本的二代测序亦有利于帮助判断发生小细胞肺癌转化的可能性(TP53/ target=_blank class=infotextkey>P53突变和Rb1失活),但对基因融合和扩增的敏感度偏低。
31位专家投票,31位赞同。
问题3:在使用EGFR酪氨酸激酶抑制剂前和耐药时进行外周血游离DNA检测的地位?
共识:在缺乏组织样本时,推荐进行外周血游离DNA检测是有意义的,帮助用于原发诊断和疾病进展时的耐药机制识别。
证据水平:I,推荐等级:A。
讨论:对于疑似非小细胞肺癌患者,组织活检是必不可少的。如果组织样本缺乏/不足时,外周血游离DNA检测是一种可能的选择,检测范围应包括EGFR基因18、19、20、21外显子上所有突变,所有阴性结果应谨慎解读。约25%的非小细胞肺癌患者属于不脱落者(non-shedder),他们的肿瘤释放很少的DNA,低于现有检测方法的检出限。
使用EGFR酪氨酸激酶抑制剂发生疾病进展时,进行外周血游离DNA检测有利于帮助获取耐药机制信息,同时也避免了组织样本带来的肿瘤异质性问题。然而组织学改变,比如小细胞肺癌转化和上皮向间质转化(EMT),只能通过组织活检识别。另外,外周血游离DNA检测对于识别基因融合和MET扩增仍有困难。
越来越多的证据表明,外周血游离DNA检测可用于EGFR靶向治疗的疗效和耐药预测,但需要更大样本的随机临床研究证实。EGFR靶向治疗的外周血游离DNA动态监测应严格限制在临床研究内,或特定的患者,比如罕见EGFR突变患者。
31位专家投票,28位赞同,3位反对。
问题4:EGFR突变和PD-L1表达检测应同时进行吗?
共识:EGFR突变(或其它生物标志物)和PD-L1表达检测应同时进行,以迅速而有效的对患者进行归类。
证据水平:I,推荐等级:A。
讨论:PD-1/PD-L1免疫单药或联合化疗已成为非小细胞肺癌的标准治疗方法之一。EGFR突变和ALK融合非小细胞肺癌患者,即使PD-L1高表达,对PD-1/PD-L1免疫单药不敏感。而且,在PD-1/PD-L1免疫后或联合使用EGFR酪氨酸激酶抑制剂,尤其是奥希替尼,可能导致严重的不良反应。
31位专家投票,31位赞同。
问题5:接受了肿瘤完全切除术的非鳞状非小细胞肺癌患者有必要进行EGFR突变检测吗?
共识:非鳞状非小细胞肺癌患者的术后靶向辅助治疗前要求进行EGFR突变检测。
证据水平:I,推荐等级:A。
讨论:2020年12月,美国FDA基于ADAURA三期研究数据,批准奥希替尼用于IB-IIIA期非小细胞肺癌EGFR突变(Del 19和21 L858R)患者的术后辅助治疗。
31位专家投票,30位赞同,1位反对。
问题6:EGFR 20外显子插入突变的生物学背景和治疗相关性?
共识:EGFR 20外显子插入突变对EGFR信号有激活作用,并具有治疗意义。针对该类突变,特定靶向治疗初现疗效。
证据水平:I,推荐等级:A。
讨论:EGFR外显子20插入突变在EGFR阳性的非小细胞肺癌中占比约12%,临床特征与经典EGFR突变患者类似,低的肿瘤突变负荷,与其它驱动基因不共存。762至774号氨基酸构成了EGFR 20号外显子的激酶区域,包含两个重要区域:762-766位的调节性C螺旋结构、以及紧邻着的767-774位氨基酸形成的环。大多数EGFR外显子20插入突变发生在767-775位氨基酸残基上。
EGFR 20外显子插入突变的手术患者的无进展生存期低于经典EGFR突变患者,但总生存期没有显著性差异。晚期患者接受化疗的预后与其它患者类似。与经典EGFR突变患者类似,EGFR 20外显子插入突变对免疫治疗不敏感。
大多数EGFR外显子20插入突变对传统EGFR酪氨酸激酶抑制剂不敏感,除位于762-766位的调节性C螺旋结构的少数几种突变之外,如A763_Y764insFQEA突变。针对EGFR外显子20插入突变的靶向药物有poziotinib,mobocertinib和amivantamab等。
基于EGFR 20外显子插入突变高度异质性,推荐二代测序进行基因检测。
31位专家投票,31位赞同。
问题7:有必要检测和报告EGFR突变晚期非小细胞肺癌患者的共存基因突变吗?
共识:EGFR突变晚期非小细胞肺癌患者的共存基因突变对预后和临床疗效可能有不利影响。在没有直接影响的情况下,对共存基因突变可以展开研究调查,但不是必要的。
证据水平:I,推荐等级:A。
讨论:EGFR突变晚期非小细胞肺癌患者的共存基因突变对临床疗效和治疗决策的影响仍无共识。常见的共存基因突变为TP53(40-65%),NKX2-1(12-17%),PIK3CA (9-12%),RB1 (10%),CTNNB1(5-9%)和CDK4(7-10%)。其它可能有影响的基因突变有PTEN,ATM,IDH1,KRAS,KEAP1-NFE2L2 信号通路改变,BRCA1,NOTCH1,FAT1 和ABCB1,以及ERBB2和MET扩增等。
这些共存基因突变对手术后患者的预后意义不明。
TP53和RB1突变与TMB正相关。TP53突变可能会减弱EGFR靶向疗效,但存在争议。以往对TP53突变进行分类,比如破坏性/非破坏性,致病性/非致病性,8号外显子/非8号外显子等,研究对EGFR靶向疗效的影响,现已被否定。目前认为所有的TP53突变对EGFR靶向疗效的影响是相同的。TP53突变和Rb1失活可能会显著增加发生小细胞肺癌发生概率。多种其它共存基因突变可能对EGFR靶向疗效有不利影响,但研究结果不一致,需要更多的数据支持。
31位专家投票,29位赞同,2位反对。
早期和局部晚期
问题1:奥希替尼用于IB-IIIA期非小细胞肺癌EGFR突变(Del 19和21 L858R)患者的术后辅助治疗的地位?
共识:到目前为止,奥希替尼被推荐用于IB-IIIA期(7th TNM)非小细胞肺癌EGFR突变(Del 19和21 L858R)患者的术后辅助治疗,为期三年。无进展生存期(DFS)和脑转移控制率的改善令人印象深刻,最好能得到总生存期和生活质量的成熟数据支持。
证据水平:I,推荐等级:A。
讨论:术后患者的辅助治疗目的是为了提高治愈率,通常用5年生存率表示。以顺铂为主的联合化疗用于IB-IIIA期(7th TNM)非小细胞肺癌的辅助治疗可以提高治愈率,而EGFR酪氨酸激酶抑制剂用于辅助治疗是否能提高治愈率仍不确定。二个第一代EGFR酪氨酸激酶抑制辅助治疗的临床研究显示,未能将无进展生存期转化成总生存期获益。ADAURA研究显示,不论是否接受了化疗辅助治疗,相对安慰剂,奥希替尼辅助治疗均能显著延长无进展生存期(HR 0.17)和脑转移控制率(HR 0.18)。需要总生存期数据,以确定是否能提高治愈率。
31位专家投票,29位赞同,2位反对。
问题2:第一代和第二代EGFR-TKI用于IB-IIIA期非小细胞肺癌EGFR突变患者的术后辅助治疗的地位?
共识:目前无确凿证据显示第一代和第二代EGFR-TKI可以用于IB-IIIA期(7th TNM)非小细胞肺癌EGFR突变患者的术后辅助治疗。
证据水平:I,推荐等级:A。
讨论:CTONG-1104和IMPACT研究显示,吉非替尼二年术后辅助治疗未能提高总生存期。
31位专家投票,28位赞同,2位反对,1位弃权。
问题3:彻底手术切除的EGFR突变非小细胞肺癌患者的术后随访?
共识:彻底手术切除的EGFR突变非小细胞肺癌患者的术后随访应遵循现行的ESMO指南。考虑到EGFR突变患者发生脑转移的概率相对较高,推荐每6个月一次的脑部影像检查(首选MRI)。
证据水平:I,推荐等级:A。
讨论:彻底手术切除的EGFR突变非小细胞肺癌患者,手术后2年内,每6个月进行一次胸部/上腹部增强CT检查,每年一次胸部低剂量CT(以检测第二原发肿瘤),2年后,仍应继续随访,每4-6个月一次胸部/上腹部增强CT检查。考虑到EGFR突变患者发生脑转移的概率相对较高,定期进行脑部影像检查是必要的,以提早发现,进行治疗决策,包括SRS。
31位专家投票,29位赞同,2位弃权。
问题4:化疗应该用于IB-IIIA期非小细胞肺癌EGFR突变患者的术后辅助治疗吗?
共识:对于身体评分良好IB-IIIA期(7th TNM)非小细胞肺癌EGFR突变患者,强烈推荐术后辅助化疗,不论是否使用靶向治疗。对于边缘阴性的高风险IB期患者,如果身体评分良好,可考虑术后辅助化疗。
证据水平:I,推荐等级:A。
讨论:基于多个随机研究和Meta分析的高级别证据,对于身体评分良好的IB-IIIA期(7thTNM)非小细胞肺癌患者,术后辅助化疗是标准方案。ADAURA研究中,约60%的患者接受了辅助化疗,奥希替尼和安慰剂二组平衡。尽管不论是否接受了辅助化疗,奥希替尼辅助治疗均有获益,但接受过辅助化疗的患者二年无进展生存率更高(HR 0.16 Vs 0.23),提示化疗的增效作用。需要注意的是,ADAURA研究并没有考虑到评估辅助化疗的作用,也没有进行分层,因此不能得出任何相关结论。CTONG-1104和IMPACT研究中,仅安慰剂组患者接受了辅助化疗,因此无法明确辅助化疗是否对靶向辅助治疗有增效作用。
A similar approach can be recommended for patients with stage Ib disease and candidatesfor adjuvant EGFR TKIs.此句不理解,故未翻译。
31位专家投票,29位赞同,1位反对,1位弃权。
问题5:奥希替尼在不符合ADAURA研究入组标准的早期非小细胞肺癌EGFR突变患者中术后辅助治疗的地位?
共识:从ADAURA研究数据外推,对于不完全切除或有残余病灶的,或经放疗的早期非小细胞肺癌EGFR突变患者,可以考虑使用奥希替尼辅助治疗。对于罕见敏感EGFR突变患者,需个体化治疗。
证据水平:II,推荐等级:C。
讨论:ADAURA研究入组患者均为肺叶或肺全切除术。考虑到根治手术还存在多种限制性切除治疗方式,比如节段切除,楔形切除和袖状切除,包括使用电视胸腔镜手术或机器人手术方式进行微创手术,可考虑在这部分患者中使用奥希替尼辅助治疗。
对于病理边缘阳性的患者,比如显微镜下有肿瘤细胞残留(R1),肉眼可见有肿瘤残留(R2)和不确定有残留(R(un)),术后局部治疗(再次手术或放疗)需进行多学科评价。强烈推荐辅助化疗,而辅助放疗仍缺乏共识。尽管在多个指南里推荐对病理边缘阳性的患者进行术后辅助放疗,但临床研究数据仍不充分。对于IB-IIIA期非小细胞肺癌EGFR突变患者,如果病理边缘阳性,此类患者复发风险较高,即使不符合ADAURA研究入组标准,也可考虑对使用奥希替尼辅助治疗。
对于IA 1-3期(8thTNM,T=1~3cm)非小细胞肺癌EGFR突变患者,不推荐使用奥希替尼辅助治疗。ADAURA研究中,IB期患者使用奥希替尼辅助治疗的获益显著小于II-IIIa期患者(DFS HR 0.39vs 0.17)。
对于罕见敏感EGFR突变患者,需针对具体的突变类型,进行个体化治疗。对于EGFR L861Q,S7681,G719X和L747P或合并经典突变(Del 19或L858R),可参考奥希替尼治疗晚期患者的数据。对于E709X单突变或复合突变,S768I合并其它罕见突变,不推荐使用奥希替尼辅助治疗。
31位专家投票,28位赞同,2位反对,1位弃权。
问题6:奥希替尼在符合ADAURA研究入组标准,但又有耐受性顾虑的早期非小细胞肺癌EGFR突变患者中辅助治疗的地位?
共识:对于高龄,间质性肺炎等并存病,术后恢复不彻底,ECOG PS评分≥2,心脏损害或恶性肿瘤史的早期非小细胞肺癌EGFR突变患者,即使符合ADAURA研究入组标准,考虑使用奥希替尼辅助治疗时,应按个别情况处理。应尽一切努力优化并发症,并进行额外的安全监测,将不良事件的个体风险与未知的总生存期影响结合,和潜在的无进展生存期获益相平衡。
证据水平:II,推荐等级:C。
讨论:ADAURA研究的入组标准:年龄≥18岁,ECOG PS 0-1,术后彻底恢复,随机分配时距术后不长于10周(如果未接受辅助化疗)或不长于26周(如果接受了辅助化疗)。排除标准:限制药物吸收的肠内并发症,无法控制的活动性感染,QTc>470 msec,心律、传导或静息心电图形态学上的临床重要异常,增加 QTc 延长风险或心律失常事件风险的因素,直系亲属40岁以下不明原因的猝死或正在服用任何已知延长QT间期的相关药物,肺部并发症(间质性肺炎史,药物导致的间质性肺炎,需要激素治疗的放射性肺炎,或其它临床活动性间质性肺炎等)和器官功能不全。
奥希替尼具有心脏毒性风险,与剂量成正比。对于服用奥希替尼的晚期患者,基线心脏损害者将增高发生心脏不良事件的风险。推荐服用奥希替尼前,优化现有心脏疾病用药。服用奥希替尼后,定期监测心脏功能。对于有心脏疾病的患者,使用奥希替尼辅助治疗时,推荐进行风险收益评估,并增加安全监测。
ADAURA研究入组患者的中位年龄64岁(范围30-86岁),小于65岁的患者与65岁以上患者的无进展生存期获益没有明显差异(HR 0.16 Vs 0.22)。考虑到高龄患者的并发症和同时使用药物较多,对使用奥希替尼辅助治疗时,增加安全监测是有必要的。
ADAURA研究中奥希替尼组发生间质性肺炎的比例为3%,安慰剂组为0%。当患者基线有间质性肺炎时,是奥希替尼的相对或绝对用药禁忌症,需仔细评估风险收益比。
当术后恢复不彻底或随机分配时距术后长于10周(如果未接受辅助化疗)或长于26周(如果接受了辅助化疗)时,需仔细评估风险收益比。
31位专家投票,27位赞同,2位反对,2位弃权。
问题7:奥希替尼在未手术的早期非小细胞肺癌EGFR突变患者中放疗后治疗的地位?
共识:对于早期非小细胞肺癌EGFR突变患者,不推荐立体定向体部放射治疗(SBRT)序贯或联合奥希替尼。
证据水平:III,推荐等级:C。
讨论:对于T1-2N0M0非小细胞肺癌患者,尤其是手术高风险的患者,SBRT是一个重要治疗选项。一项大样本研究,SBRT治疗早期非小细胞肺癌患者的5年局部复发率为10.5%,区域复发率12.7%,远处转移率19.9%。共存并发症是该类患者死亡风险的重要因素。SBRT治疗早期非小细胞肺癌EGFR突变患者的数据有限。目前也没有临床数据支持SBRT治疗期非小细胞肺癌EGFR突变患者时,序贯或联合奥希替尼。
31位专家投票,27位赞同,3位反对,1位弃权。
问题8:奥希替尼在可手术或临界可切除(比如T3/T4)的IA-IIIA非小细胞肺癌EGFR突变患者中新辅助治疗的地位?
共识:目前没有数据支持在可手术或临界可切除(比如T3/T4)的IA-IIIA期非小细胞肺癌EGFR突变患者中新辅助治疗使用奥希替尼。
证据水平:II,推荐等级:C。
讨论:NeoADAURA研究正在进行中,奥希替尼单药或联合含铂化疗对比含铂化疗用于II-IIIB期非小细胞肺癌EGFR突变患者的新辅助治疗。
31位专家投票,27位赞同,3位反对,1位弃权。
问题9:免疫检查点抑制剂疗法在III期非小细胞肺癌EGFR突变患者根治性化放疗后巩固治疗的地位?
共识:目前不推荐免疫检查点抑制剂用于III期非小细胞肺癌EGFR突变患者根治性化放疗后的巩固治疗。
证据水平:I,推荐等级:C。
讨论:PD-L1抑制剂度伐利尤单抗已被FDA和EMA批准用于III期非小细胞肺癌患者根治性化放疗后的巩固治疗。PACIFIC研究结果显示,度伐利尤单抗组的4年无进展生存率和4年总生存率显著高于对照组(35.3% vs 19.5%,49.6% vs. 36.3%)。该临床研究并没有限制基因突变类型,度伐利尤单抗组内的43例EGFR突变患者,中位无进展生存期HR 0.84(95% CI:0.40–1.75),中位总生存期HR 0.97(95% CI: 0.40–2.33)。另一项小样本回顾性研究分析,37例III期非小细胞肺癌EGFR突变患者根治性化放疗后,其中接受度伐利尤单抗巩固治疗的患者相对其它患者的无进展生存率没有差异,而且发生严重免疫不良反应的比例较高。
31位专家投票,28位赞同,3位弃权。
问题10:EGFR酪氨酸激酶抑制剂在不可手术的III期非小细胞肺癌EGFR突变患者放疗前,时和后中的地位?
共识:目前不推荐不可手术的III期非小细胞肺癌EGFR突变患者放疗前,时和后使用EGFR酪氨酸激酶抑制剂。
证据水平:III,推荐等级:C。
讨论:回顾性研究显示,不可手术的III期非小细胞肺癌患者经根治性放化疗后,相对EGFR野生患者,EGFR突变患者的局部控制率和远处转移率更高。临床前模型试验显示,EGFR酪氨酸激酶抑制剂联合放疗有增效作用。但目前为上,仍无证据支持不可手术的III期非小细胞肺癌EGFR突变患者放疗前,时和后使用EGFR酪氨酸激酶抑制剂。
LAURA研究正在进行中,评估在不可手术的III期非小细胞肺癌EGFR突变患者放化疗后使用奥希替尼巩固治疗的临床疗效。
31位专家投票,28位赞同,2位反对,1位弃权。
问题11:奥希替尼辅助治疗期间或结束后出现疾病复发时的最佳治疗方案?
共识:这种临床情况的前瞻性数据有限。数据显示,如果奥希替尼辅助治疗结束后出现疾病复发,再挑战奥希替尼很可能有效,推荐再次服用奥希替尼三年。然而,如果奥希替尼辅助治疗期间出现疾病复发,推荐停止奥希替尼,对复发病灶进行组织活检,检测耐药机制,用以指导下一步治疗方案。局部消融疗法可能可用于寡复发病灶。
证据水平:I,推荐等级:A。
讨论:SELECT研究是一项EGFR突变IA-IIIA期非小细胞肺癌术后厄罗替尼辅助治疗的单臂二期临床试验,一共有40名患者复发,其中仅有4名是在厄罗替尼辅助治疗期间内发生,24名患者复发后重新取样做了基因检测,成功完成了20例检测,全部保留着EGFR驱动基因突变,而合并T790M阳性只有一例。26名复发患者再次使用厄罗替尼,中位治疗持续时间为13.1个月。一项单中心的回顾性分析,65例I-III期非小细胞肺癌EGFR突变患者术后接受厄罗替尼或吉非替尼辅助治疗,22例复发,中位辅助治疗时间17个月,其中7例为辅助治疗期间复发,T790M比例67%;15例为辅助治疗结束后复发,T790M比例0%,再挑战EGFR-TKI的客观有效率为73%,中位至疾病进展时间10个月。尽管缺乏奥希替尼的前瞻性数据,基于这二个研究结果的外推,当奥希替尼辅助治疗结束后出现疾病复发时,推荐再次服用奥希替尼三年。
如果奥希替尼辅助治疗中间出现疾病复发,情况类似于治疗晚期患者时出现疾病进展。局部消融疗法可用于寡复发病灶。这类患者的耐药机制相对第一代或第二代EGFR-TKI异质性更强,看起来不像有一种主要的或占主导地位的耐药机制存在,组织再活检很有必要。二种可治疗的耐药机制为MET扩增(可使用EGFR-TKI联合MET-TKI)和小细胞肺癌转化(可使用依托泊苷联合卡铂)。如果耐药机制无针对性方案,参考后续章节——晚期 问题3D。
31位专家投票,30位赞同, 1位弃权。
晚期
问题1:常见EGFR突变患者的最佳一线治疗方案是什么?
共识:优先选择第三代EGFR-TKI,如奥希替尼作为携带常见EGFR突变的晚期非小细胞肺癌患者的一线治疗方案。
证据水平:I,推荐等级:A。
讨论:在2021年,已经推荐优先选择第三代EGFR-TKI作为携带常见EGFR突变(Del 19或L858R)的晚期非小细胞肺癌患者的一线治疗方案。相对第一代EGFR-TKI(厄罗替尼和吉非替尼),第二代EGFR-TKI(阿法替尼和达可替尼)的中位无进展生存期更长一些,但不良反应显著更大。奥希替尼是最常用的第三代EGFR-TKI,FLAURA研究结果显示,对比第一代EGFR-TKI,奥希替尼显著延长了无进展生存期和总生存期。尽管亚组分析结果显示,对于亚洲患者和L858R突变患者,奥希替尼没有总生存期优势,但专家组认为不应限制奥希替尼用于一线治疗这二类患者。其它第三代EGFR-TKI,比如阿美替尼,lazertinib,伏美替尼,Rezivertinib,ASK120069,SH-1028,D-0316和Abivertinib,已经在亚洲国家上市或在临床研究中。如果不能获得第三代EGFR-TKI,患者应使用第一代或第二代EGFR-TKI。
一些一线治疗联合方案的研究显示了有趣的结果,例如抗血管生成药联合第一代EGFR-TKI,吉非替尼联合含铂化疗等,但未成为标准方案。这些联合方案缺乏与第三代EGFR-TKI的随机对照研究数据。奥希替尼单药对比奥希替尼联合培美曲塞/铂类一线治疗携带常见EGFR突变的晚期非小细胞肺癌患者的FLAURA2研究正在进行中。
31位专家投票,30位赞同, 1位弃权。
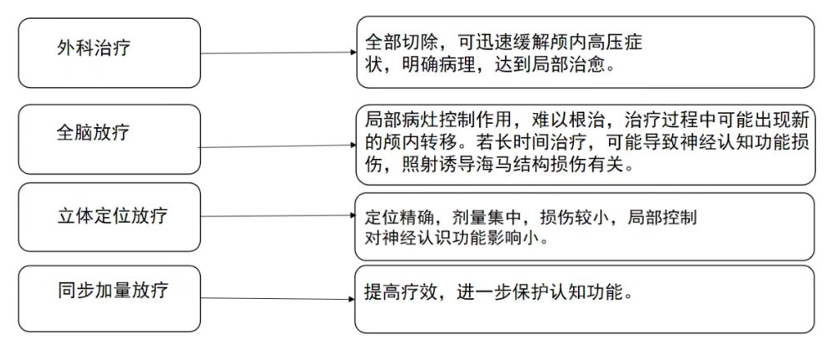
问题2:脑转移和或脑膜转移患者的最佳治疗方案?
共识:第三代EGFR-TKI应作为脑转移(包括脑膜转移)EGFR突变非小细胞肺癌患者的首选初始治疗方案。前瞻性对照试验结果并不支持放疗联合EGFR-TKI。当这些患者使用奥希替尼(80mg每天一次)出现颅内进展时,选择立体定向放射外科治疗,避免全脑放,进行局部治疗后继续原剂量的奥希替尼是标准方案,也可以考虑增加奥希替尼剂量到160mg每天。对于脑膜转移患者,奥希替尼160mg每天是首选剂量。
证据水平:II,推荐等级:A。
讨论:厄罗替尼,吉非替尼和阿法替尼对脑转移EGFR突变非小细胞肺癌有效,尽管它们的血脑屏障穿透能力相对弱一些。FLAURA研究结果显示,奥希替尼有比厄罗替尼或吉非替尼更佳的脑转移控制率,更低的脑转移进展概率。Lazertinib也显示了潜在的中枢神经系统活性。AZD3759在一期研究中显示了良好的血脑屏障穿透能力和中枢神经系统活性。
对于脑转移患者,放疗扮演了重要的角色。放疗的时机仍然是个有争议的问题。一项回顾性研究显示,脑转移患者在靶向药前先用SRS的总生存期最长。对于预期生存期较长的患者,全脑放带来的潜在神经认知后遗症是需要优先考虑的问题。
脑膜转移患者的预后很差。初诊患者中脑膜转移比例很低,大多数相关研究仅使用MRI作为检查手段。小样本研究显示,厄罗替尼脉冲方案对一些EGFR突变脑膜转移非小细胞肺癌患者有效。奥希替尼80mg每天一次对未使用过EGFR-TKI的脑膜转移患者有效。BLOOM研究结果显示,奥希替尼160mg每天对脑膜转移患者疗效良好。基于该研究,很多国家已经将奥希替尼160mg每天作为EGFR突变非小细胞肺癌脑膜转移患者的标准治疗方案。脑膜转移患者在EGFR-TKI的基础上联合脑部放疗的疗效仍不清楚。尽管如此,在BLOOM研究中的许多患者接受了脑部放疗。
31位专家投票,28位赞同,3位弃权。
问题3:奥希替尼治疗失败后的最佳治疗方案?
后期治疗取决于患者和疾病特征,基因检测结果,获得治疗或临床试验的机会。
问题3A:奥希替尼治疗失败后,EGFR基因改变患者的最佳治疗方案?
共识:临床实践中,应将含铂化疗视为标准方案。如果奥希替尼治疗失败后发现新的EGFR突变,在临床试验的背景下,替代性的靶向疗法应被视为首选治疗方案,包括酪氨酸激酶抑制剂(TKI),单克隆抗体(mAb)和抗体药物偶联物(ADC)。
证据水平:II,推荐等级:B。
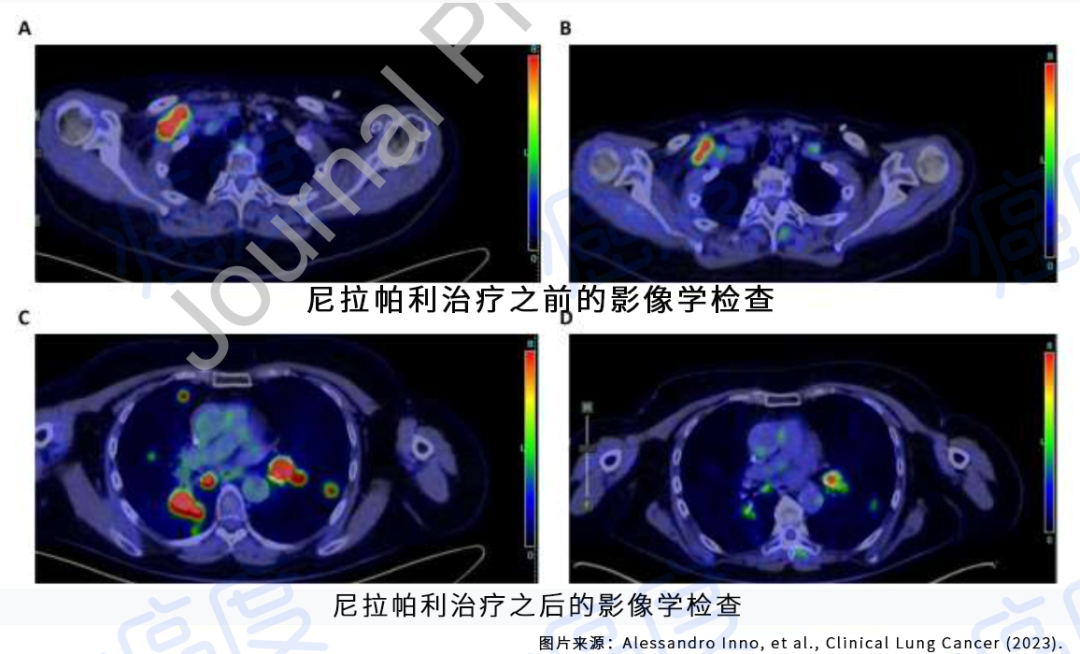
讨论:奥希替尼一线治疗失败后,约15%的患者发生EGFR耐药突变,包括C797S(最常见),L718Q,L792F和G796S等。因为奥希替尼的结构与第一代和第二代EGFR-TKI不同,这些EGFR突变可能并不会影响第一代和第二代EGFR-TKI的敏感性,已经在一些患者身上观察到临床疗效。奥希替尼二线治疗T790M阳性患者失败后,约25%的患者发生EGFR耐药突变。这些EGFR耐药突变只有在与T790M成反式时,才可能对奥希替尼联合第一代EGFR-TKI敏感。然而这些EGFR突变大多数(>95%)与T790M成顺式。1/2期临床研究中,amivantamab(JNJ-6372)单药或联合Lazertinib,和Patritumab Deruxtecan(U3-1402)均对这些EGFR耐药突变有临床活性。
31位专家投票,26位赞同,3位反对,2位弃权。
问题3B:奥希替尼治疗失败后,可靶向旁路基因改变患者的最佳治疗方案?
共识:奥希替尼的耐药机制包括可靶向旁路基因改变,例如MET扩增和HER2扩增等。尽管含铂化疗仍是标准方案,这类患者应优先考虑参加针对性的分子驱动临床试验。
证据水平:II,推荐等级:B。
讨论:MET扩增是奥希替尼耐药患者中最常见的非靶标相关耐药机制(10-15%)。奥希替尼联合MET抑制剂的临床研究显示出令人振奋的结果。奥希替尼联合赛沃替尼治疗MET扩增的奥希替尼耐药患者,客观有效率为30%。奥希替尼联合特泊替尼的二期临床试验(INSIGHT 2研究,NCT03940703),奥希替尼联合卡帕替尼的二期临床试验(GEOMETRY-E研究,NCT04816214),均正在进行中。
Amivantamab(JNJ-6372)联合Lazertinib治疗奥希替尼耐药患者的客观有效率为36%,其中携带EGFR和MET相关耐药机制的患者更为敏感。PatritumabDeruxtecan治疗奥希替尼耐药患者的客观有效率为39%,对多种耐药机制均观察到临床活性,包括EGFR C797S,MET或HER2扩增和BRAF融合等。
对于发生ALK融合阳性的奥希替尼耐药患者,奥希替尼联合ALK-TKI已有个例报道。
奥希替尼联合selpercatinib(一种RET-TKI)治疗发生RET融合阳性的奥希替尼耐药患者,亦有个例报道显示出持久的缓解。
31位专家投票,28位赞同,3位反对。
问题3C:奥希替尼治疗失败后,组织学改变患者的最佳治疗方案?
共识:对于发生小细胞肺癌转化的EGFR-TKI耐药患者,推荐依托泊苷联合卡铂化疗方案。化疗期间是否联合奥希替尼仍是未知的。对于发生鳞癌转化等其它组织学改变的EGFR-TKI耐药患者,选择相应的化疗方案。这类患者进行免疫治疗应在临床试验中进行评估。
证据水平:IV,推荐等级:B。
讨论:小细胞肺癌转化在EGFR-TKI耐药患者中约占3-10%,也有在原发耐药患者中发现。最近发现其它组织学改变(包括鳞癌转化)在奥希替尼耐药患者中约占15%。组织学改变需要通过组织(再)活检来确定。常见共存基因TP53,Rb1和PIK3CA突变,可能会在发生组织学改变前检测到。TP53和Rb1基因的彻底失活可能会增加患者发生小细胞肺癌转化的机率,其它基因改变如高APOBEC突变等也可能与此有关。Marcoux等报道,58例EGFR突变非小细胞肺癌患者从确诊至发生小细胞肺癌转化的中位时间为17.8月,从EGFR-TKI治疗开始至发生小细胞肺癌转化的中位时间为15.8月,中位总生存期为31.5月,发生小细胞肺癌转化后的中位生存期为10.9月。46例患者接受依托泊苷联合卡铂化疗方案的客观有效率为54%,中位无进展生存期3.4月,20例患者接受含紫杉醇类化疗方案的客观有效率为50%,中位无进展生存期2.7月,17例患者接受免疫治疗的客观有效率为0。
化疗期间是否联合奥希替尼仍是未知的,相关临床研究(NCT03567642)正在进行中。
度伐利尤单抗(一种PD-L1单抗)联合Olaparib(一种PARP抑制剂)治疗发生小细胞肺癌转化的EGFR突变非小细胞肺癌患者的二期临床研究(NCT04538378)正在进行。
31位专家投票,28位赞同,1位反对,2位弃权。
问题3D:奥希替尼治疗失败后,没有可靶向基因改变患者的最佳治疗方案?
共识:对于肿瘤缓慢进展的患者,而且临床症状没有恶化,可考虑继续奥希替尼直至症状恶化或肿瘤明显进展。
优先考虑参加临床试验,或使用含铂化疗±贝伐珠单抗,含铂化疗联合阿替利珠单抗和贝伐珠单抗亦是一个选项。含铂化疗联合PD-1/PD-L1单抗治疗此类患者的临床疗效仍未得到验证。
对于寡转移进展患者,包括脑转移患者,可考虑手术或放疗等局部治疗手段,并继续奥希替尼。
证据水平:II,推荐等级:B。
讨论:含铂化疗治疗第一代EGFR-TKI的客观有效率30%,中位无进展生存期5-6月。CheckMate-722和KEYNOTE-789二个三期临床研究将验证含铂化疗联合PD-1单抗治疗此类患者的临床疗效。IMpower150三期研究纳入了58例经典EGFR突变非鳞癌非小细胞肺癌患者,紫杉醇+卡铂+阿替利珠单抗+贝伐珠单抗对比紫杉醇+卡铂+贝伐珠单抗有总生存期获益(HR 0.60;95% CI:0.31–1.14)。ORIENT-31三期研究的首次中期分析结果显示,信迪利单抗+培美曲塞+顺铂+ IBI305(一种贝伐珠单抗的生物类似药)对比培美曲塞+顺铂有中位无进展生存期获益(mPFS 6.9vs 4.3月; HR 0.46 CI 95%:0.33–0.63; p<0.0001)。
奥希替尼耐药患者在后续化疗期间是否联合奥希替尼基于经验来决定。尽管IMPRESS研究结果显示,吉非替尼耐药患者在后续化疗期间联合吉非替尼无临床获益,但考虑到药物特性不同,以及奥希替尼具有良好的脑转移控制能力,在化疗期间继续使用奥希替尼是合理的。当然这需要前瞻性临床试验来证实。
对于颅内外病灶同时进展的患者,优先选择对脑转移病灶进行局部放疗并进行化疗。
31位专家投票,29位赞同,1位反对,1位弃权。
问题4:EGFR-TKI再挑战的地位?
共识:EGFR-TKI治疗失败(包括脑转移)患者,在停用EGFR-TKI半年以上时,而且没有可靶向的基因改变,没有针对性的分子驱动临床试验时,可考虑EGFR-TKI再挑战。
证据水平:III,推荐等级:C。
讨论:化疗是奥希替尼耐药患者的主流治疗方案。一些新的方法,包括化疗联合奥希替尼,仍在研究中。利用潜在的耐药机制知识,尝试利用合理的组合疗法来挽救患者。以往第一代和第二代EGFR-TKI再挑战的数据显示有效率和临床获益不太高。
奥希替尼耐药患者的第一步是进行组织再活检,当没有发现可靶向的基因改变,或没有相关的临床研究可参加时,奥希替尼再挑战是合理的选择。停用奥希替尼>6个月的患者,再挑战的获益可能性更大。奥希替尼再挑战时,推荐标准剂量(80mg每天一次)。对于脑转移患者,奥希替尼再挑战也是合理的。
31位专家投票,28位赞同,1位反对,2位弃权。
问题5:EGFR突变患者免疫检查点抑制剂疗法的地位?
共识:不论PD-L1表达情况,在有其它标准治疗方案时,不推荐EGFR突变患者使用免疫检查点抑制剂单药治疗,因为有效率低下,而且会增大后续EGFR-TKI治疗时的不良反应。对于新确诊的非小细胞肺癌患者,在进行免疫治疗前应先获得基因检测结果。
证据水平:II,推荐等级:B。
讨论:临床数据显示免疫检查点抑制剂单药治疗EGFR突变患者有效率低下。有趣的是,不同的EGFR突变亚型对免疫检查点抑制剂的响应不一,例如罕见EGFR突变>L858R>Del 19。一项帕博利珠单抗治疗PD_L1高表达EGFR突变患者的临床试验因缺乏有效率而提早终止。
免疫检查点抑制剂单药治疗EGFR突变患者发生超进展的比例也相对更高,约20%。
阿替利珠单抗或纳武利尤单抗联合厄罗替尼的临床试验没有发现临床疗效和不良反应的负面影响。而度伐利尤单抗联合吉非替尼或奥希替尼的临床试验却发现显著增高的严重不良反应比例,比如肝功能损害和肺炎。EGFR突变患者在免疫检查点抑制剂疗法后序贯使用EGFR-TKI,发现有相关的毒性反应,可能与免疫检查点抑制剂较长的半衰期有关。
31位专家投票,28位赞同,3位弃权。
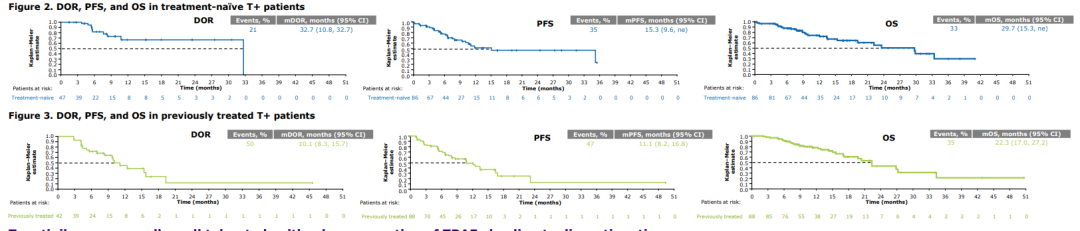
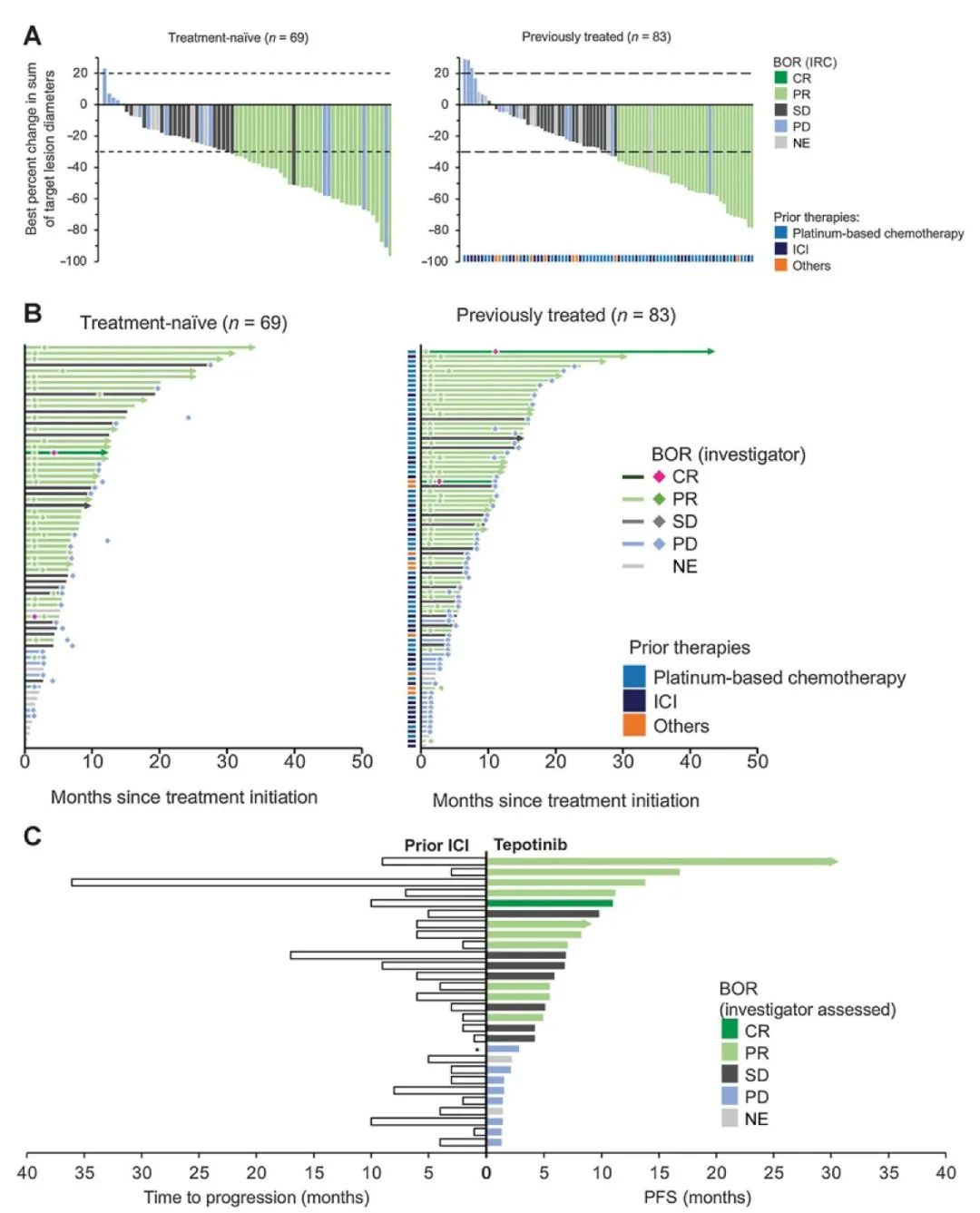
问题6:EGFR 20号外显子插入突变患者的最佳治疗方案?
共识:含铂化疗应作为EGFR 20号外显子插入突变患者的一线治疗方案,不联合免疫检查点抑制剂,以避免增加后续靶向治疗时的潜在毒性风险。推荐Amivantamab和Mobocertinib作为二线治疗药物。
证据水平:II,推荐等级:B。
讨论:略。
31位专家投票,26位赞同,2位反对,3位弃权。
问题7:EGFR 罕见突变患者的最佳治疗方案?
共识:推荐阿法替尼或奥希替尼作为EGFR 罕见突变(G719X,L861Q,S768I或复合突变等)患者的一线治疗药物。在缺乏上述药物时,推荐含铂化疗。
证据水平:II,推荐等级:B。
讨论:略。
31位专家投票,29位赞同,1位反对,1位弃权。
问题8:EGFR突变合并其它驱动患者的最佳治疗方案?
共识:使用二代测序,以确定哪一种驱动基因占优势。推荐含铂化疗±TKI。
证据水平:IV,推荐等级:C。
讨论:略。
31位专家投票,27位赞同,1位反对,3位弃权。